Oxi là nguyên tố vô cùng quan trọng trong đời sống hàng ngày của tất cả các sinh vật cũng như con người trên trái đất này, Oxi là nguyên tố hay còn được gọi là đơn chất phi kim oxi. Đây là một kiến thức chúng ta đã từng tìm hiểu ở trong trường lớp cũng như ở trong đời sống thường ngày. Liệu chúng ta đã thực sự hiểu hết về nguyên tố này chưa, Oxi có mấy hóa trị, tính chất, đặc điểm và vai trò của oxi như thế nào thì dưới bài viết này chúng ta cùng nhau đi tìm hiểu về nó nhé
Đặc điểm nguyên tố Oxi:
Oxi (hay còn gọi là Oxy, Ôxi, Oxygen) là nguyên tố phi kim có số hiệu nguyên tử là 8, nguyên tử khối là 16 đvC thuộc nhóm VI A chu kì 2.
Theo hoá học thì Oxi thuộc cấu hình e, có nguyên tử là 1s22s22p4. Đây là nguyên tố hoá học vô cùng phổ biến trên Trái Đất, nó chiếm khoảng 20% thể tích trong không khí, và 50% khối lượng vỏ của Trái Đất, và 60% khối lượng cơ thể của con người.
Hóa trị của liti ( Li ), tính chất hóa học và khối lượng nguyên tử
Hidro (H) hóa trị mấy? Nguyên tử khối và tính chất hóa học
Còn ở trong điều kiện tự nhiên thì nguyên tố Oxi có 3 đồng vị: 16 0, 17 0 và 18 0. Tiếp đến, bạn có thể tìm thấy oxi ở trong các hợp chất và đặc biệt nhất là các loại oxit của kim loại như SiO3 và CO3
Oxi có hóa trị: II
Tính chất của Oxy :
Tính chất vật lý

Tính chất hóa học của Oxi
Oxi tác dụng với kim loại
Phản ứng đặc trưng của oxi là phản ứng cháy. Oxi có thể tác dụng với hầu hết các kim loại dưới tác dụng của nhiệt độ để tạo ra các oxit (trừ kim loại vàng và bạch kim Oxi không phản ứng).
Ví dụ:
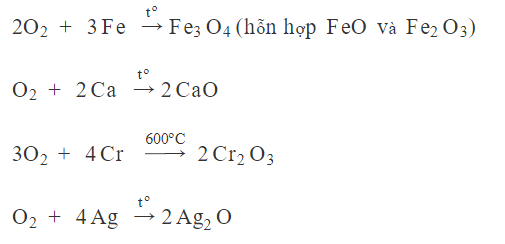
Tác dụng với phi kim :
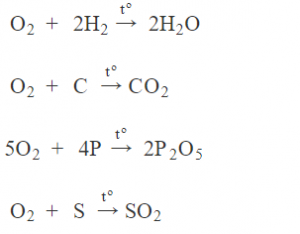
Oxi tác dụng với các hợp chất khác
Vì là nguyên tố có độ âm điện cao, Oxi còn có thể tác dụng với rất nhiều các chất để tạo thành những hợp chất mới.
- C CO2 Phương trình hóa học Cacbon tác dụng với Cacbon Dioxit.
- H2O CO2 = H2CO3 Viết Phương Trình Nước Tác Dụng Với Khí CO2.
2SO2 + O2 → 2SO3
2Fe + O2 + 2H2O → 2Fe(OH)2
C5H12O2 + 7O2 → 5CO2 + 6H2O
3O2 + CS2 → CO2 + 2SO2
2N2+ 5O2 + 2H2O → 4HNO3
4FeCl2 + O2 + 4HCl → 4FeCl3 + 2H2O
2Na2O2 + 2H2O + 4CO2 → 4NaHCO3 + O2
BaO4+ 4H2O → Ba(OH)2 + 3H2O2
Điều chế oxi
Để điều chế được oxi chúng ta sẽ có 2 cách để điều chế:
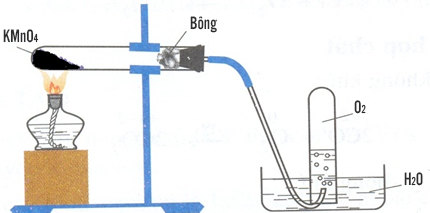
Trong phòng thí nghiệm
Ở phòng thí nghiệm thì oxi sẽ được điều chế bằng cách phân hủy một số hợp chất giàu oxi và rất ít bền với nhiệt như KCLO3(rắn), KMnO4(rắn),…
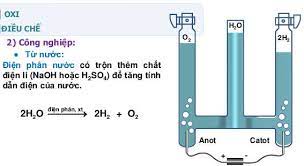
Trong công nghiệp
Từ không khí: Sau khi đã loại bỏ được hết hơi nước, khí cacbon đioxit, bui trong không khí và được hóa lỏng thì sẽ thu lại được oxi. Oxi sẽ được bảo quản và vận chuyển ở trong bình thép với áp suất 150atm và dung tích 100 lít.
Ứng dụng và vai trò của Oxi
Oxy có vai trò vô cùng to lớn trong cơ thể người nói riêng và sinh vật hiếu khí nói chung. Nó là nguyên liệu cho quá trình đốt cháy tạo năng lượng để sinh công cho các cơ quan hoạt động, duy trì thân nhiệt …, ngoài ra còn tham gia vào phản ứng biến dưỡng và nhiều phản ứng sinh hóa khác, tất cả các nhóm phân tử cấu trúc chính trong các cơ thể sống như các protein, cacbohydrat, và mỡ đều chứa ôxy, cũng như trong các hợp chất vô cơ quan trọng cấu tạo tạo nên các răng và xương.
Vậy là chúng ta vừa tìm hiểu xong về nguyên tố oxi về các vấn đề như vị trí trong bảng tuần hoàn, tính chất vật lí và tính chất hóa học của nguyên tố Oxi. Hi vọng sẽ giúp ích được cho các em học sinh nắm vững được kiến thức quan trọng để làm bài tập.
Xem thêm hóa trị của các nguyên tố tại đây :
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
Nitơ ( N ) hóa trị mấy? Cấu tạo phân tử của N
Hóa trị của Cacbon là mấy ( C ), Nguyên tử khối và cách điều chế chuẩn
Hóa trị của nguyên tố Bo ( B ), Tính chất và vai trò của nguyên tố B
Hóa trị của Beri ( Be), Tính chất và hợp chất chuẩn của Be